| 項次 | 提問 | 說明 |
|
1
|
哪些病人可以參加ADCTA-SSI-G1臨床試驗?
|
ADCTA-SSI-G1第三期臨床試驗是針對復發性惡性神經膠質腦瘤(Recurrent GBM)的患者進行收案。經醫師診斷可能有腫瘤復發,預計安排再開刀之病患,只要符合篩選條件的受試者將被納入試驗。 |
|
2
|
復發性惡性神經膠質腦瘤(Recurrent GBM)的現行標準治療為何?
|
惡性腦瘤標準治療方法為外科手術、體外放射治療合併口服化療藥物temozolomide治療,治療後若病情持續惡化或再復發時,並無其他有效的藥物或療法供選擇。目前健保局將標靶藥物bevacizumab(Avastin®, 癌思停)用於治療第一線治療失敗後復發的惡性神經膠母細胞瘤病患。 |
|
3
|
參加ADCTA-SSI-G1臨床試驗會不會影響我接受標準治療?
|
ADCTA-SSI-G1第三期臨床試驗以不影響病患接受標準治療的前提下,將受試者分成兩組(試驗組和對照組),僅試驗組的病患除接受常規標準治療外,附加自體樹突細胞/腫瘤抗原(ADCTA-SSI-G1)免疫療法。 |
|
4
|
為什麼要參加ADCTA-SSI-G1臨床試驗?
|
本臨床試驗提供病患多一項選擇,有機會接受新興免疫細胞輔助療法。依據專家學者的研究分析當多型性神經膠質母細胞瘤(GBM)再復發,患者存活時間將大幅縮短;此外,腫瘤對化學治療、放射治療容易產生抵抗性,使腦瘤的治療效果不佳,再復發機率高。 |
|
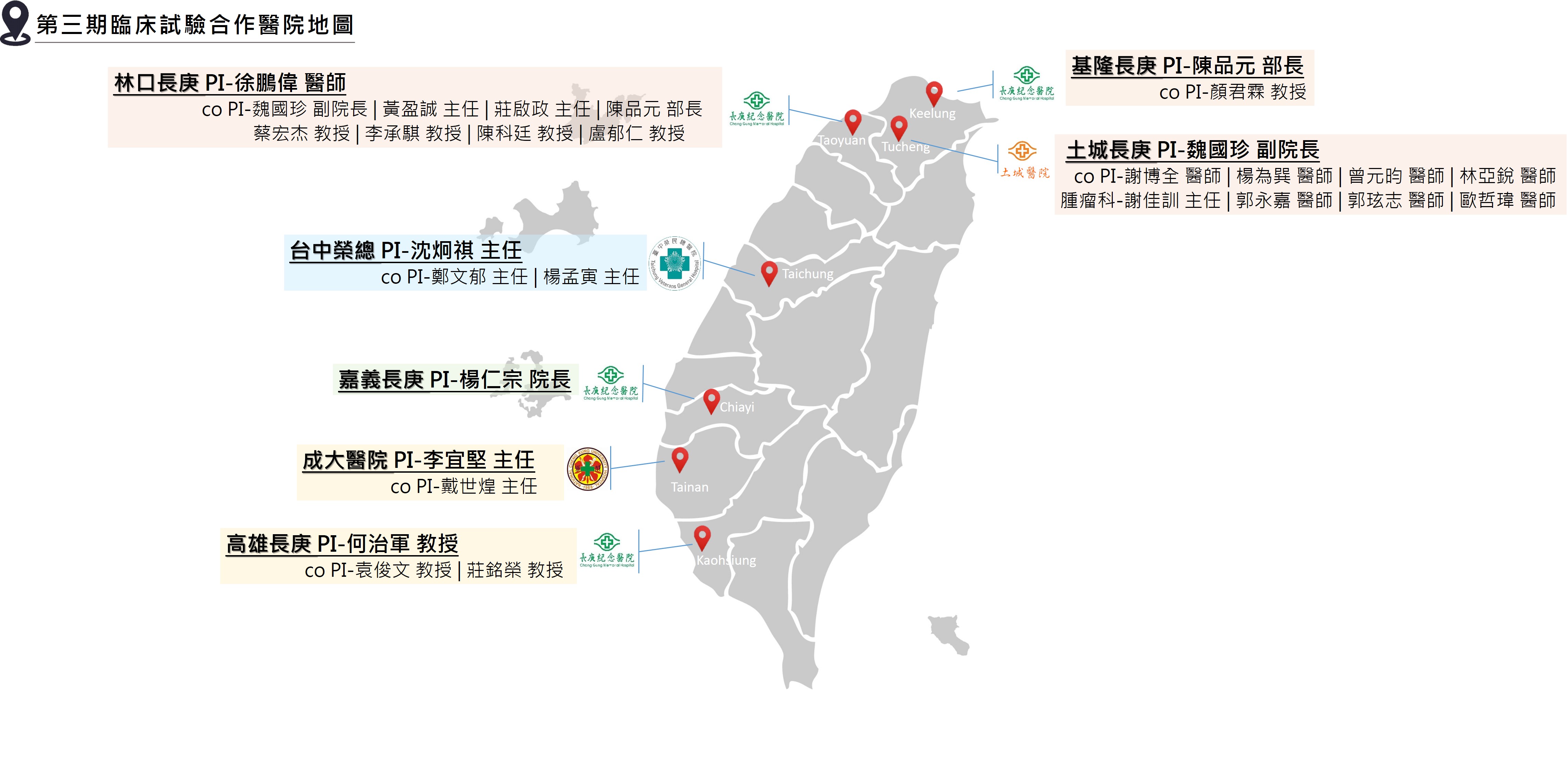
5
|
目前哪些醫院有參與ADCTA-SSI-G1臨床試驗?
|
目前參與ADCTA-SSI-G1第三期臨床試驗計畫的醫院包含林口長庚醫院、基隆長庚醫院、嘉義長庚醫院、高雄長庚醫院、台中榮民總醫院、台南成大附設醫院及新北土城長庚醫院。 |
|
6
|
參與ADCTA-SSI-G1臨床試驗需要配合哪些事項?
|
所有想要參與ADCTA-SSI-G1第三期臨床試驗的病患,須同意提供常規手術後的剩餘腫瘤組織,作為腫瘤抗原的材料;並於正式加入試驗後,如果被分派到試驗組,則須配合進行周邊血液分離術,採集周邊血液單核細胞。 |
|
7
|
參與ADCTA-SSI-G1臨床試驗需要注意哪些事項?
|
目前常規使用的免疫療法(例如:免疫檢查點抑制劑),治療過程中會影響免疫系統,可能降低ADCTA的治療成效,若參與ADCTA-SSI-G1第三期臨床試驗,則不可使用相關免疫療法。 |
|
8
|
我可以隨時退出臨床試驗嗎?
|
任何參與臨床試驗的病患,在療程期間可以隨時退出試驗,且不會因此影響您原有的醫療照護。 |

